susar在临床试验中的意思
笔者现将药物警戒活动中与临床研究相关的SUSAR和DSUR报告,以及上市后的PSUR和PBRER报告有关要求进行梳理对比,供行业参考。
王海燕
2019年发布的《药品管理法》明确建立药物警戒制度。为规范药品上市许可持有人和获准开展药物临床试验的药品注册申请人依法承担药物警戒主体责任,2020年12月3日,国家药品监督管理局发布《药物警戒质量管理规范(征求意见稿)》,向社会公开征求意见。
自2017年我国药品监督管理部门加入ICH后,6个E2系列药物警戒指导原则电子传输执行指导原则;3.E2C:定期获益-风险评估报告;4.E2D:上市后安全性数据的管理:快速报告的定义和标准;5.E2E:药物警戒计划;6.E2F:研发期间安全性更新报告)也已开始逐步转化实施。药品监管部门通过要求药品注册申请人/持有人及时报告可疑且非预期严重不良反应SUSAR、定期报告仍处于临床开发中药品的安全性的DSUR、定期报告已批准药品的安全性的PSUR),以及提交定期获益-风险评估报告PBRER对产品的总体利益-风险特征进行评估,在上市申请和/或PSUR中可能提交的ICH指导原则E2E的安全性规范章节,以规划药物警戒活动。
笔者现将药物警戒活动中与临床研究相关的SUSAR和DSUR报告,以及上市后的PSUR和PBRER报告有关要求进行梳理对比,供行业参考。
可疑且非预期严重不良反应报告(SUSAR)
(一)相关法规
2018年1月25日发布的《总局关于适用国际人用药品注册技术协调会二级指导原则的公告》明确,自2018年5月1日起,药物临床研究期间报告严重且非预期的药品不良反应适用《E2A:临床安全数据的管理:快速报告的定义和标准》《M1:监管活动医学词典(MedDRA)》和《E2B(R3):临床安全数据的管理:个例安全报告传输的数据元素》。
为落实上述公告内容,2018年4月27日,CDE发布《药物临床试验期间安全性数据快速报告的标准和程序》,自2018年5月1日后开始实施的临床试验,按照该标准和程序执行。
2018年7月27日,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,明确:对于药物临床试验期间出现的可疑且非预期严重不良反应和毒理研究提示重大安全性风险信号,申请人应按照《药物临床试验期间安全性数据快速报告标准和程序》中相关要求向药审中心递交安全性报告。2020年3月30日发布的《药品注册管理办法》中固化该要求,第三章第二十八条明确规定,对于药物临床试验期间出现的可疑且非预期严重不良反应和其他潜在的严重安全性风险信息,申办者应当按照相关要求及时向药品审评中心报告。2020年7月1日,国家药监局药品审评中心发布的《药物临床试验期间安全信息评估与管理规范》第二章第四条规定,临床试验期间,申请人应通过药物警戒电子传输系统及时提交可疑且非预期严重不良反应个例报告,通过药审中心网站按时提交其它潜在的严重安全性风险信息报告。SUSAR个例报告、其它潜在的严重安全性风险信息报告相关要求,按照药审中心发布的《药物临床试验期间安全性数据快速报告标准和程序》执行。
(二)报告范围
1.申请人获准开展药物临床试验后,对于临床试验期间发生的所有与试验药物肯定相关或可疑的非预期且严重的不良反应,以及其他潜在的严重安全性风险信息。
2.以下三种情况,也应该进行快速报告:(1)以上临床试验期间,申请人从其它来源获得的与试验药物相关的非预期严重不良反应及其他潜在严重安全性风险的信息;(2)申请人和研究者在不良事件与药物因果关系判断中不能达成一致时,其中任一方判断不能排除与试验药物相关的情形;(3)临床试验结束或随访结束后至获得审评审批结论前发生的严重不良事件,由研究者报告申请人,若属于非预期严重不良反应,也应进行快速报告。
(三)报告方式
通过药物警戒电子传输系统(PV系统)及时提交。
(四)报告时限
1.快速报告开始时间为临床试验批准日期/国家药品审评机构默示许可开始日期,结束时间为国内最后一例受试者随访结束日期。对于国际多中心临床研究,“临床试验期间”SUSAR快速报告是指从临床试验批准日期/国家药品审评机构默示许可开始日期开始,至全球最后一例受试者随访结束日期。
2.根据严重不良事件的性质按以下时限向国家药品审评机构快速报告:对于致死或危及生命的非预期严重不良反应,申请人应在首次获知后尽快报告,但不得超过7天,并在随后的8天内报告、完善随访信息;对于非致死或危及生命的非预期严重不良反应,申请人应在首次获知后尽快报告,但不得超过15天;申请人在首次报告后,应继续跟踪严重不良反应,以随访报告的形式及时报送有关新信息或对前次报告更改信息等,报告时限为获得新信息起15天内。
研发期间安全性更新报告(DSUR)
(一)相关法规
国家药品监督管理局2018年7月27日发布的《关于调整药物临床试验审评审批程序的公告》第十五条规定,申请人在获得首次临床试验许可后,应定期向药审中心提供药物研发期间安全性更新报告,包括全球研发和上市状况、正在进行中和已完成的临床试验、新增的安全性结果、重大生产变更、整体安全性评估、重要风险总结、获益—风险评估和下一年总体研究计划等内容。一般每年一次,于药物临床试验许可后每满一年后的两个月内提交。药审中心可以根据审查情况,要求申请人调整报告周期。逾期未提交的,申请人应暂停药物临床试验。新《药品注册管理办法》对相关内容进行了固化。
2019年11月12日,国家药品监督管理局发布《关于适用E1:人群暴露程度:评估非危及生命性疾病长期治疗药物的临床安全性等15个国际人用药品注册技术协调会指导原则的公告》,明确适用《E2F:研发期间安全性更新报告》及《E2F示例》。
2020年7月1日CDE发布的《药物临床试验期间安全信息评估与管理规范》第二章第四条规定,临床试验期间,申请人应通过药审中心网站按时提交研发期间安全性更新报告。DSUR相关要求按照药审中心发布的《研发期间安全性更新报告管理规范》执行。临床试验期间发生临床试验方案变更、非临床或者药学的变化或者有新发现的,申请人应充分评估对受试者安全的影响。评估认为不影响受试者安全的,应在DSUR中报告;如果可能增加受试者安全性风险的,应当提出补充申请。7月1日,CDE同时发布了《研发期间安全性更新报告管理规范》,规范报告的撰写和管理,并明确:原国家食品药品监督管理局药品审评中心《关于化学药IND申请药学研究数据提交事宜的通知》中要求的《化学药IND申请药学研究年度报告》与研发期间安全性更新报告统一,不再单独提交;申请人应按照ICH E2F《研发期间安全性更新报告》的要求准备、撰写和提交DSUR。
(二)报告范围
1.申请人获准开展药物(包括中药、化学药及生物制品)临床试验后,均应向CDE提交DSUR。
2.DSUR中应包含报告周期内收集到的与药物(无论上市与否)相关的安全性信息全面深入的年度回顾和评估,应讨论报告周期内发现的所有安全性问题,不应作为新的重要安全信息的初始报告途径,也不应作为新的安全问题的检出途径。
3.DSUR侧重研究药物,只有当对照药物与临床试验受试者的安全相关时,才需提供对照药物的信息。
4.DSUR应包含与所有剂型和规格、所有适应症以及研究中接受研究药物的患者人群相关的数据(化学药和生物制品应按照相同活性成分,中药按照相同处方进行准备)。如果相关信息无法获得(如申请人尚未获得数据),申请人应在DSUR的前言部分予以解释说明。
(三)报告方式
通过CDE官网“申请人之窗”“研发期间安全性相关报告递交”栏目递交。
(四)报告时限
1.原则上应将药物临床试验在境内或者全球首次获得临床试验许可日期(即“国际研发诞生日”,以下简称DIBD)的月和日,作为年度报告周期的起始日期。首次提交应在境内临床试验获准开展后第一个DIBD后两个月内完成,后续提交也应以DIBD为基准。
2.应持续提交至该药物境内最后一个上市许可申请提交,或者在境内不再继续进行研发时为止。最后一次提交时应附说明文件,说明该次提交为在境内的最后一份DSUR,并说明申请人是否还在其他国家或者地区继续进行临床试验。
定期安全性更新报告(PSUR)
(一)相关法规
为加强药品上市后管理,2011年5月4日原卫生部发布的《药品不良反应报告和监测管理办法》中明确要求生产企业需提交定期安全性更新报告。为落实81号令有关要求,规范和指导药品生产企业撰写药品定期安全性更新报告,在主要参考ICH E2C《上市药品定期安全性更新报告》内容的基础上,原国家食品药品监督管理局制定了《药品定期安全性更新报告撰写规范》,并于2012年9月6日发布执行。
(二)报告范围
1.取得药品批准证明文件的上市后药品(对于实施批准文号管理的原料药、辅料、体外诊断试剂,对于实施批准文号管理的中药材、中药饮片以及进口中药材,以及对于境内药品生产企业接受境外委托生产但未获得我国批准证明文件的产品,不需要提交PSUR)。
2.对上市后药品的不良反应报告和监测资料进行定期汇总分析,汇总国内外安全性信息,进行风险和效益评估。
3.对于同一活性成分药品有多个批准证明文件【涵盖不同给药途径、适应症(功能主治)或者目标用药人群等】,可以按照一个批准证明文件提交一份PSUR;也可以遵循化学药和生物制品按照相同活性成分、中成药按照相同处方组成报告《定期安全性更新报告》。在一份《定期安全性更新报告》内,可以根据药物的不同给药途径、适应症(功能主治)或目标用药人群进行分层。
(三)报告方式
通过国家药品不良反应监测系统报告《定期安全性更新报告》。
(四)报告时限
1.对于设立新药监测期的国产药品,应当自取得批准证明文件之日起每满1年提交一次定期安全性更新报告,直至首次再注册,之后每5年报告一次;其他国产药品,每5年报告一次。
2.首次进口的药品,自取得进口药品批准证明文件之日起每满1年提交一次定期安全性更新报告,直至首次再注册,之后每5年报告一次。
3.数据汇总时间以取得药品批准证明文件的日期为起点计,上报日期应当在汇总数据截止日期后60日内。可以提交以国际诞生日(IBD,在世界上任何国家或地区的首次上市批准)为起点计的《定期安全性更新报告》,但如果上述报告的数据截止日早于我国要求的截止日期,应当补充这段时期的数据并进行分析。
定期获益-风险评估报告(PBRER)
(一)相关法规
2020年7月21日,国家药品监督管理局发布《关于可适用E2C:定期获益-风险评估报告国际人用药品注册技术协调会指导原则的公告》,明确:自公告发布之日起,药品上市许可持有人提交定期安全性更新报告可适用《E2C:定期获益-风险评估报告》国际人用药品注册技术协调会三级指导原则。药品上市许可持有人可以提交PBRER,也可按照81号令和《国家食品药品监督管理局关于印发药品定期安全性更新报告撰写规范的通知》的要求提交报告。
(二)报告范围
1.在国际诞生日或药物开发的国际诞生日(DIBD,在任何国家和地区进行干预性临床试验的首次授权日期)起可能获得的任何相关有效性/疗效信息的背景下,从可用数据来源对相关的新的安全性信息进行评估,是对总体数据的评估。
2.PBRER应包括产品的累积知识,同时将重点放在新信息上。
3.上市后研究的相关信息或未经批准的适应症或人群的临床试验的相关信息也应包括在PBRER中。
(三)报告方式
通过国家药品不良反应监测系统报告(注:药品上市许可持有人可以使用PBRER代替PSUR递交)。
(四)报告时限
1.向监管机构提交PBRER报告和提交报告的频率需要遵守国家或区域监管要求,通常取决于批准日期、产品在市场上的时间长短、对产品的利益-风险特征的了解程度等因素。PBRER格式和内容旨在适用于报告期为6个月或正常的定期报告。一但药物已经上市好几年,国家或区域的法规可能允许提交的频率延长到更长的时间间隔。
2.数据锁定时间:对于新批准的产品,一般区域要求6个月的周期(至少在批准后的前2年);对于常规/定期提交的PBRER,报告应基于累积数据,间隔数据集为6个月或其倍数。
3.数据锁定点与提交之间的时间间隔:覆盖6个月或12个月的期限,70个日历日内;间隔时间超过12个月,90个日历日内。
DSUR、PSUR和PBRER对比
(一)DSUR & PSUR
1.从报告范围看,DSUR侧重于研究药物,PSUR针对已获批上市药物的安全性进行定期报告。
2.从内容上看,DSUR和PSUR很可能会有重叠,并有一定的重复。如:上市后的信息可能会与临床研发相关,因此应在DSUR中报告。DSUR中可能会包含已上市药物在临床试验中获得的安全性结果,属于上市后安全性信息,也应在PSUR中报告。因此,《研发期间安全性更新报告管理规范》第八条规定,当药物在境内外获得了上市许可,如申请人需要,可以在IBD的基础上准备和提交DSUR。调整后的首次提交,报告周期不应超过一年。
3.从接收部门看,DSUR应提交至药品审评中心,PSUR应提交至药品评价中心。
(二)PSUR & PBRER
PSUR主要目的是全面了解经批准的药品的安全性。PBRER的主要目的是对关于药品风险的新的或新出现的信息及其对已批准的适应症的益处进行全面、简明和批判性的分析,以便对产品的总体利益-风险特征进行评估。PBRER比PSUR更为重视利益,特别是当风险评估发生重要变化时;比PSUR更加强调药品的累积知识,并将重点放在新信息上。
(三)PBRER & DSUR
鉴于DSUR是对研究药物DIBD为基准的相关安全性信息进行全面深入的年度回顾和评估;PBRER是对药物IBD或DIBD为基准的可能获得任何相关有效性/疗效信息,从可用数据来源对相关的新的安全性信息进行评估。因此,如果药品的DSUR的DIBD与ICH E2F中建议的同一产品的PBRER的IBD一致,只要数据锁定点是相同的,即当每个报告覆盖基于IBD的一年间隔时,则DSUR多个章节的内容可以在PBRER中使用。
(四)DSUR、PSUR和PBRER资料要求对比
相关文章
-
celine的意思是什么
Celine是法国巴黎的著名品牌,由女设计师Celine Vipiana于1945年创立,起初以贩卖童鞋为主,之后皮件、服装系列陆续上市。它所生产的服装、皮包、女鞋、皮手套等产品,无论从配件到设计、生产还是选材,都相当丰富精致,强调与服装之间的和谐搭配性。充满当代风格的Celine是最能展现职业女性风采的法国奢侈品牌。Celine品牌风格浓烈、洒脱独立,让女性时刻挥洒自如、彰显温柔魅力。精致的品牌形象出自女性之手,专为女性打造,采用舒适材料精工细作,精湛高质的技艺成就堪称完美的CELINE巴黎经典时装。
2024-03-16 阅读 (130) -

鸟雀呼晴侵晓窥檐语中侵的意思是
燎沉香,消溽暑①。鸟雀呼晴,侵晓窥檐语②。叶上初阳干宿雨③。水面清圆,一一风荷举。焚烧沉香,来消除夏天潮湿的暑气。鸟雀呼唤着晴天,拂晓时分我偷偷听它们在屋檐下的说话声。初出的阳光晒干了荷叶上昨夜的雨,水面上的荷叶清润圆正,一阵风吹来,荷叶一团团舞动起来。下片抒情,写梦回家乡。“故乡遥,何日去?家住吴门,久作长安旅”,这几句直抒自己对故乡的思念,感叹自己的羁旅生涯,不假雕饰,平白如话。“五月渔郎相忆否?小楫轻舟,梦入芙蓉浦”,词人不言自己思念亲戚故旧,却问渔夫是否思念自己,从对面更深一层地表达自己的思念。“
2024-09-01 阅读 (98) -
保时捷macan的中文名的意思
1、保时捷Macan是一款中型SUV。“Ma来自can”一词是源于印度尼西亚语译为“老虎”,作为保时捷的中型SUV,Macan采用了奥迪Q5的底盘,原厂配备米其林轮胎,保时捷的家族式前脸不会缺少,独特的掀背式设计和Q5具有本质的差别;2、在设计上更加趋向运动化的风格,使其看上去像是一款跨界车。Macan的推出,填补了保时捷品牌在中型SUV市场的空白,以高品牌价值来自、运动感的造型和差异化的订制服务在易力市场上掀起一轮新的竞赛;
2024-04-06 阅读 (118) -

女人梦到包包失而复得是啥意思
八万余元的存折从丢失到复得仅用了15分钟......1月21日正定县公安局执勤民警在正定县恒州市场巡逻过程中捡到存折一本和公交卡一张执勤人员在附近询问周边群众无果后立即前往该存折开户银行查询存折持有人相关信息经查发现存折持有人为一位老人存折内有八万余元并且没有设置密码考虑到老人一定非常着急民警立即查询到
2023-09-21 阅读 (184) -
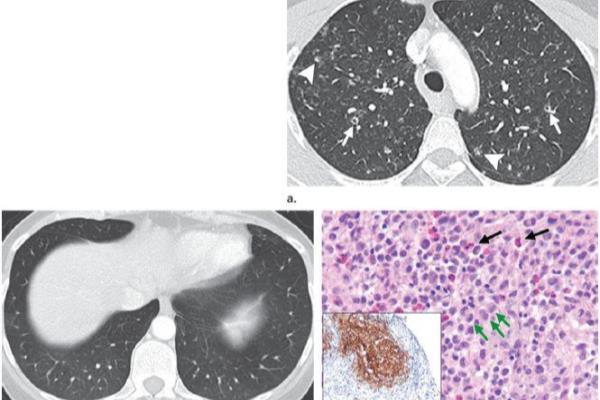
眼睛检查有朗格汉斯细胞是啥意思
图1 44岁女性PLCH患者。a 薄层CT显示边界不清的结节影,主要位于双肺上叶,这些结节是典型PLCH细胞浸润早期表现。部分结节中心部分是透亮的,提示将要囊变。b CT图像显示双肺底部未受累。c 组织病理学检查,显微镜下图像显示细胞核皱缩、折叠的朗格汉斯细胞和嗜酸性粒细胞。CD1a免疫组化染色显示成片朗格汉斯细胞被染成特征性的棕色。
2025-12-10 阅读 (71) -
有钱难买心头好上一句的意思
俗话说:有钱难买心头好。原本意思是说真正能带来满足感的东西不是用钱能买到的。但国外一项新研究却证明,消费者只要买对了东西,比如符合自身个性的东西,还是能给自己带来幸福。分析结果显示,那些把钱花在符合自身个性事物上的人都有着更高的生活满意度。例如一个外向型的人晚上喜欢去酒吧喝酒,对家庭、事业有责任心的人会更多地为“健康健身”付账,等等。研究人员认为,事实上,个性与总支出或总收入相比,在消费与生活满意度之间的确扮演着更重要的角色。
2024-06-21 阅读 (109) -
网络语8203啥意思
消费型无人机普及以后,给予视频创作者更大的创作空间,好莱坞大片既视感的航拍镜头不再遥不可及。 怎样拍出好素材呢? 一、了解你的无人机 无论是拍摄视频素材还是照片,... 穿越汽车、自行车、快艇等等,这样的拍摄最大的难度在于飞手如何判断飞行器与拍摄主体的距离,以及气流的影响。 4、拍出镜头速度感 一般的多轴飞行器最高速度在45km/h,... 小景别的航拍与大景别相反。
2024-05-10 阅读 (227) -
902在爱情里面的意思
902的意思是就你爱,9代表就、久,0代表你,2代表爱,902的意思就是就你爱。表示女孩喜欢你的意思。2——代表爱情。下面就是数字含义大全 0——代表圆满、完美、无尽。4——代表是的、实时。9——代表久、就、求。九零二是网络语言。1——代表唯一、你 、 起点。3——代表想念、生命、生活。5——代表我,也可以理解为不分你我。
2024-09-28 阅读 (492) -
精工手表7n42是啥意思啊
先逐一解释一下您提供的信息WATER RESISTANT 10BAR,即10个大气压防水,也叫100米防水ST.STEEL即不锈钢表壳7N42,是机芯型号。这是一款精工石英机芯,时分时秒大三针、日历显示、月差15秒、电池寿命3年0BV0 A4,这是表壳料号,代表手表外壳的形制。但这个料号市场上并不常用,所以一般很难用来确认精工表的具体款式以上信息都无法确认是哪一款,所以只能说这类精工表的市场价1500元左右如有帮助,还望选为满意答案...
2024-07-17 阅读 (118) -
guess是啥意思是什么
这是口语中常用的一个句式,意思是:“你猜怎么着?”说话者通常用这句话引出要报告的好消息。比如:Guess what? I received an offer from my dream university!你猜怎么着?我收到了梦寐以求的大学的录取通知书。搭配“good news”的意思是“好消息”。注意,表示“消息”的名词“news”不可数,所以想表示“一个消息”,不能说“a news”,而应该说“some news”或者“a piece of news”。
2024-09-29 阅读 (102)
热门资讯
-
三个字:729去喝酒、756辛苦了、721亲爱的、456是我啦、546我输了、356上网了、510我依你(我已来)、765去跳舞、360想念你、809保龄球、520我爱你、530我想你、740气死你、886拜拜了、078你去吧、501我愿意、987对不起、095你找我、234爱相随、246笨死了、537我生气、918加油吧、065原谅我、098你走吧、147一世情、200爱你哦、282饿不饿、230爱上你、300想你哦、310先依你、440谢谢你、514无意思、555呜呜呜、587我抱歉、706...
2024-09-25 阅读 (912) -
 2024-07-12 阅读 (663)
2024-07-12 阅读 (663) -
1417数字爱情代表的意思是:一世(在)一起。1——代表唯一的爱情 ;2——代表两人世界;3——代表分散,双方随分隔两地,但思念永不改变 ;4——代表无尽的思念;5——是我的意思,也可以理解为不分你我; 6——代表顺利,代表喜剧式的爱情双方的爱情将一帆风顺,幸福过一生 ;7——代表凄美,代表爱情注定经历坎坷,或许中间有很痛苦的事,但双方要用爱来度过 ;8——是可以看成两个0靠在一起,是最浪漫的一个,指标是两个人肩靠肩的样子 ;9——代表永久,爱你一生一世直到永久的意思 ;10——代表十全十美,完美的爱情。
2024-08-07 阅读 (619) -
 2024-06-08 阅读 (545)
2024-06-08 阅读 (545) -
最近,网上有一个视频,是一个男生在大庭广众之下,拿着一束花向女生表白。结果女生的表情很不好,对男生说下一次吧,男生也恼了。今天就跟大家聊聊,道德绑架式表白什么意思?这种所谓的“道德绑架式表白”,其实就是指的在大庭广众之下表白,也许女生根本就不愿意,却要被周围围观的群众逼着答应。之前我就遇到过一个类似的事情,男生在公共场合表白,女生给拒绝了,于是男生就恼羞成怒对女孩横加指责:“你不就是嫌弃我穷吗?”“我有什么不好,你为什么不喜欢我,没想到你那么势力”。
2024-08-31 阅读 (505)
最新资讯
-
 2025-12-10 阅读 (71)
2025-12-10 阅读 (71) -
 2025-10-29 阅读 (93)
2025-10-29 阅读 (93) -
2018年7月27日,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,明确:对于药物临床试验期间出现的可疑且非预期严重不良反应和毒理研究提示重大安全性风险信号,申请人应按照《药物临床试验期间安全性数据快速报告标准和程序》中相关要求向药审中心递交安全性报告。2020年3月30日发布的《药品注册管理办法》中固化该要求,第三章第二十八条明确规定,对于药物临床试验期间出现的可疑且非预期严重不良反应和其他潜在的严重安全性风险信息,申办者应当按照相关要求及时向药品审评中心报告。
2025-09-24 阅读 (77) -
lv白三彩经典款大方的设计,营造浪漫的气氛,凸显女性优雅知性气质,所以好意思用的。LV一般指路易威登。路易威登(LouisVuitton),法国奢侈品品牌,隶属于酩悦·轩尼诗-路易·威登集团,经营产品包括手提包,旅行用品,小型皮具,配饰,鞋履,成衣,腕表,高级珠宝及个性化订制服务等。
2025-08-16 阅读 (107) -
很多人每天脑子不停,晚上有时候失眠,出现瞎琢磨。胡思乱想。这里的胡思乱想就是无效思维,但是他还非常占用大脑内存。同样的消耗大脑资源。瞎琢磨的意思是汉语词语,拼音是xiā zuó mo,意思是胡乱揣测。大脑中一团乱麻,剪不断理还乱。无奈纠缠,身心疲惫。要想改变这样的思维模式,就要首先了解有效思考有哪些因素。
2025-07-22 阅读 (106)